Amónium
- Nezamieňať s amoniakom.
| Amónium | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | NH4+ |
| Synonymá | amónny ión, azanium, amónny katión |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 18,039 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 14798-03-9 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Amónium (iné názvy: amóniový katión, amónny katión, azánium[1]:64) je kladne nabitý viacatómový ión so vzorcom NH4+.[2] Vzniká protonáciou amoniaku (NH3). Soli, ktoré obsahujú amónny katión, sa nazývajú amónne soli. K amónnym soliam sú zvyčajne radené i kladne nabité alebo protonované substituované amíny alebo kvartérne amónne soli (NR4+), kde je jeden alebo viac vodíkových atómov nahradených organickou skupinou (značenú R).
Acidobázické vlastnosti
[upraviť | upraviť zdroj]
Amónny ión vzniká, keď amoniak, čo je slabá zásada, reaguje s Brønstedovou kyselinou (donorom protónu):
- H+ + NH3 → NH4+
Amónny ión je mierne kyslý a reaguje s Brønstedovými zásadami, čím sa mení naspäť na neutrálny amoniak:
- NH4+ + B- → HB + NH3
Z toho vyplýva, že miešaním koncentrovaných roztokov amónnych solí so silnými zásadami vzniká amoniak. Keď sa amoniak rozpustí vo vode, malá časť sa mení na amónne ióny:
- H2O + NH3 ↔ OH- + NH4+
Množstvo amoniaku, ktoré sa premení na amónne ióny, závisí od pH roztoku. Ak je pH nízke (teda v roztoku je vysoká koncentrácia vodíkových iónov), rovnováha sa posunie doprava: amoniak sa bude premieňať na amónne ióny. Ak je pH vysoké (teda v roztoku je nízka koncentrácia vodíkových iónov), rovnováha sa posunie doľava: hydroxidové ióny budú odoberať protóny z amónnych katiónov, takže bude vznikať amoniak.
Vznik amónnych zlúčenín môže prebehnúť i v parnej fázy: keď prídu pary amoniaku do styku s parami chlorovodíka, vytvorí sa biely oblak chloridu amónneho, ktorý sa postupne usadí ako pevná látka do tenkej bielej vrstvičky na povrchoch.
Soli
[upraviť | upraviť zdroj]
Amónny katión sa nachádza v mnohých soliach, napríklad uhličitane amónnom, chloride amónnom alebo dusičnane amónnom. Väčšina jednoduchých amónnych solí je dobre rozpustná vo vode. Výnimkou je hexachlóroplatičitan amónny: jeho tvorba sa kedysi používala ako skúška na prítomnosť amónia. Amónne soli dusičnanu a obzvlášť chloristanu sú veľmi explozívne, pričom amónium funguje ako redukčné činidlo.
Amónium môže tvoriť i amalgám. Ten sa pripravuje pridaním sodného amalgámu do roztoku chloridu amónneho.[3] Tento amalgám sa postupne rozkladá a vypúšťa amoniak a vodík.[4]
Na zistenie prítomnosti amónneho iónu v soli sa soľ zahrieva s alkalickým hydroxidom, čím vzniká plyn s charakteristickým zápachom, čo je samozrejme amoniak:
Aby sa amoniak potvrdil, plyn prechádza sklenenou tyčinkou ponorenou do roztoku kyseliny chlorovodíkovej, čím vznikajú husté biele pary chloridu amónneho:
Keď roztok amoniaku reaguje s roztokom síranu meďnatého, farba roztoku sa mení z modrej na tmavomodrú, pretože sa tvorí Schweizerovo činidlo:
Amoniak alebo amónne ióny je možno pridať k Nesslerovmu činidlu, čím vzniká hnedá zrazenina.
Prídavkom amónnych solí ku kyseline chloroplatičitej vzniká žltá zrazenina:
Prídavkom amónnych solí k kobaltonitritu sodnému vzniká žltá zrazenina:
Pridavkom amónnych solí k hydrogénvínanu draselnému vzniká biela zrazenina:
Štruktúra a väzby
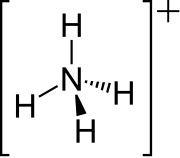
[upraviť | upraviť zdroj]Voľný elektrónový pár dusíka v amoniaku, ktorý sa zakresľuje čiarou nad N, tvorí väzbu s protónom (H+). Jedná sa o koordinačnú väzbu. Následkom toho je, že všetky štyri N–H väzby sú ekvivalentné, polárne kovalentné väzby. Amónny ión má tetraedrickú štruktúru a je izoelektronický s metánom a bórohydridom. Veľkostne sa amónny katión (rionic = 175 pm) podobá na cézny katión (rionic = 183 pm).
Organické ióny
[upraviť | upraviť zdroj]Vodíkový atóm v amónnom katióne môže byť substituovaný alkylovou skupinou alebo inou organickou skupinou za vzniku substituovaného amónneho iónu. Podľa toho, koľko vodíkov sa nahradí, vznikajú primárne, sekundárne, terciárne alebo kvartérne amónne katióny. Okrem kvartérnych amónnych katiónov (ktoré nemajú vodíkový atóm, ktorý by sa mohol odštiepiť) sú organické amónne katióny slabé kyseliny.
Príkladom tvorby organického amónneho iónu je reakcia medzi dimetylamínom (CH3)2NH a kyselinou, čím vzniká dimetylamónny katión (CH3)2NH+
2:
Kvartérne amónne katióny majú na dusíkový atóm naviazané štyri organické skupiny, čo znamená, že im úplne chýba vodíkový atóm viazaný na dusík. Tieto katióny, ako napríklad tetra-n-butylamónny katión, sa občas používajú ako náhrada sodných alebo draselných katiónov, čím sa zvyšuje rozpustnosť asociovaného aniónu v organických rozpúšťadlách. Primárne, sekundárne a terciárne amónne soli majú rovnakú funkciu, ale sú menej lipofilné. Takisto sa používajú ako surfaktanty a katalyzátory fázových prechodov.
Nezvyčajnou skupinou organických amónnych solí sú deriváty amínových katión radikálov, R3N+•, ako je tris(4-brómfenyl)amóniumylhexachlórantimoničnan.
Biológia
[upraviť | upraviť zdroj]Amónne ióny sú odpadovým produktom metabolizmu živočíchov. U zvierat a vodných bezstavovcov sa amónne ióny vylučujeú priamo do vody. U cicavcov, žralokov a obojživelníkov sa premieňajú v močovinovom cykle na močovinu, pretože močovina je menej toxická a dá sa účinnejšie skladovať. U vtákov, plazov a zemných slimákov sa premieňajú na kyselinu močovú, ktorá je pevná a teda sa vylučuje s minimálnou stratou vody.[5]
Amónne ióny sú dôležitým zdrojom dusíka pre mnohé druhy rastlín, obzvlášť pre rastliny rastúce v hypoxickej zemine. Zároveň sú však pre väčšinu plodín toxické a málokedy sa využívajú ako jediný zdroj dusíka.[6]
Kovy
[upraviť | upraviť zdroj]Amónny ión má vlastnosti podobné ťažším katiónom alkalických kovov a často sa považuje za blízky ekvivalent.[7][8][9] Predpokladá sa, že amónium sa bude pri veľmi vysokých tlakoch chovať ako kov (NH4+ ióny v poli elektrónov), podobne ako vnútri plynných obroch Uráne a Neptúne.[7][9]
Za bežných podmienok neexistuje amónium ako čistý kov, ale existuje v podobe amalgámu (zliatiny s ortuťou).[10]
Referencie
[upraviť | upraviť zdroj]- ↑ KRIVOSUDSKÝ, Lukáš; GALAMBOŠ, Michal; LEVICKÁ, Jana. Stručný sprievodca názvoslovím anorganickej chémie. ChemZi (Bratislava: Slovenská chemická spoločnosť), 2020, roč. 16, čís. 2, s. 63 – 67. Dostupné online [cit. 2022-08-15]. ISSN 1336-7242.
- ↑ amónne soli [online]. Encyclopaedia Beliana, [cit. 2021-12-02]. Dostupné online.
- ↑ Pseudo-binary compounds [online]. [Cit. 2021-12-02]. Dostupné online. Archivované 2020-07-27 z originálu.
- ↑ VIAS Encyclopedia: Ammonium Salts [online]. www.vias.org, [cit. 2021-12-02]. Dostupné online.
- ↑ CAMPBELL, Neil A.; Jane B. Reece. Biology. 6th. vyd. San Francisco : Pearson Education, Inc, 2002. Dostupné online. ISBN 978-0-8053-6624-2. 44, s. 937–938.
- ↑ BRITTO, DT; Kronzucker, HJ. NH4+ toxicity in higher plants: a critical review. Journal of Plant Physiology, 2002, s. 567–584. Dostupné online. DOI: 10.1078/0176-1617-0774.
- ↑ a b Does metallic ammonium exist?. Nature, November 20, 1975, s. 222–223. DOI: 10.1038/258222a0.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ a b Metallic Ammonium. Monthly Notices of the Royal Astronomical Society, February 3, 1954, s. 172–179. DOI: 10.1093/mnras/114.2.172.
- ↑ Lecture demonstration of ammonium amalgam. Journal of Chemical Education, October 1, 1929, s. 1767. DOI: 10.1021/ed006p1767.
Pozri aj
[upraviť | upraviť zdroj]- Hydrónium (H3O+)
- Nitrifikácia
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Ammonium na anglickej Wikipédii.



2(aq) + H2SO4(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e154ece95c36a855cc40be127cb8a8050e70736b)
 + NH4+(aq) -> (NH4)2[PtCl6](s) + 2H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1dd9fd9bb66c4ebd151f05e017d5ab27971f069)
 + 3NH4(aq) -> (NH4)3[Co(NO2)6](s) + 3Na+(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ece5991a80ec81b30f7a09f2c91c430bf40e989)

