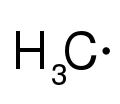Reaktívny intermediát
- Nezamieňať s heslom Reakčný intermediát.
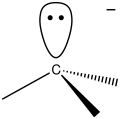
Ako reaktívny intermediát sa v chémii označuje zlúčenina alebo molekula, ktorá má vysokú energiu, krátky polčas života a je veľmi reaktívna. Keď vznikne v chemickej reakcii, rýchlo sa premení na stabilnejšiu molekulu. Tieto molekuly je možné izolovať a skladovať iba v výnimočných prípadoch, napríklad pri nízkych teplotách alebo uväznením v matrici. Keď je indikovaná prítomnosť reaktívneho intermediátu, môže pomôcť vysvetliť priebeh chemickej reakcie.[1][2][3][4]
Väčšina chemických reakcií prebieha vo viac než jednom elementárnom kroku a reaktívne intermediáty sú vysokoenergetické, ale stabilné produkty, ktoré existujú len v medzikrokoch. Sled jednotlivých krokov tvorí reakčný mechanizmus. Reaktívne intermediáty sa líšia od reaktantu, produktu alebo i reakčného intermediátu iba tým, že ich zvyčajne nie je možné izolovať, ale niekedy sú pozorovateľné rýchlymi spektroskopickými metódami. Reaktívny intermediát je stabilný v tom zmysle, že vzniká v elementárnej reakcii a je nutná ďalšia elementárna reakcia na jeho ďalšiu premenu.
Keď reaktívne intermediátu nie sú pozorovateľné, ich existencia sa musí usudzovať pomocou experimentálnych výsledkov. To väčšinou spočíva v zmene reakčných podmienok, (napríklad teploty alebo koncentrácie), aplikáciou techník chemickej kinetiky či chemickej termodynamiky alebo využitím spektroskopických metód. Reaktívne intermediáty založeé na uhlíku môžu byť radikály, karbény, karbokatióny, karbanióny, aríny a karbíny.
Spoločné vlastnosti
[upraviť | upraviť zdroj]Reaktívne intermediáty majú niekoľko spoločných vlastností:
- nízka koncentrácia v porovnaní s reaktantom alebo produktom
- reaktívne intermediáty zvyčajne nespĺňajú oktetové pravidlo, čo vysvetľuje ich vysokú reaktivitu (s výnimkou karbaniónov)
- často vznikajú pri chemickom rozklade zlúčenín
- ich existenciu je často možné dokázať pomocou spektroskopie
- je nutné uvážiť klietkový efekt
- často dochádza k stabilizácii pomocou konjugácie alebo rezonancie
- často je náročné ich rozlíšiť od tranzitného stavu
- dôkaz existencie často vyžaduje uväznenie v matrici
Uhlíkové reaktívne intermediáty
[upraviť | upraviť zdroj]-
Radikál (nespárovaný elektrón)
-
Karbén (voľný elektrónový pár na uhlíku)
-
Karbokatión (kladný náboj)
-
Karbanión (záporný náboj)
-
Karbín
-
Benzín (typ arínu)
Iné reaktívne intermediáty
[upraviť | upraviť zdroj]- Karbenoid
- Ión-neutrálny komplex
- Ketoanióny
- Nitrény
- Oxokarbéniové ióny
- Fosfinidény
- Fosforylnitridy
- Tetrahedrálne intermediáty v karbonylových adičných reakciách
Referencie
[upraviť | upraviť zdroj]- ↑ Carey, Francis A.; Sundberg, Richard J.; (1984). Advanced Organic Chemistry Part A Structure and Mechanisms (2nd ed.). New York N.Y.: Plenum Press. ISBN 0-306-41198-9.
- ↑ March Jerry; (1992). Advanced Organic Chemistry reactions, mechanisms and structure (4th ed.). New York: John Wiley & Sons ISBN 0-471-60180-2
- ↑ GILCHRIST, T. L.. Carbenes nitrenes and arynes. [s.l.] : Springer US, 1966. ISBN 9780306500268.
- ↑ MOSS, Robert A.; PLATZ, Matthew S.; JONES, JR., Maitland. Reactive intermediate chemistry. Hoboken, N.J. : Wiley-Interscience, 2004. ISBN 9780471721499.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Reactive intermediate na anglickej Wikipédii.