Guanidín
| Guanidín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | CH5N3 |
| Synonymá | Imínometánediamín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 59,072 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 113-00-8 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Guanidín je organická zlúčenina, ktorej vzorec je HNC(NH2)2. Je to bezfarebná pevná látka, ktorá je rozpustná v polárnych rozpúšťadlách. Guanidín je silná zásada používaná vo výrobe plastov a výbušnín. Nachádza sa v moči ako bežný produkt metabolizmu bielkovín. Guanidínová skupina sa takisto nachádza vo väčších organických molekulách vrátane bočného reťazca arginínu.
Štruktúra
[upraviť | upraviť zdroj]Guanidín je vlastne dusíkatý analóg kyseliny uhličitej. To znamená, že skupina C=O v kyseline uhličitej je nahradená C=NH skupinou a každá OH skupina je nahradená NH2 skupinou.[1] Podobne sa dá predstaviť i izobutylén ako uhlíkový analóg. Napriek jednoduchosti štruktúry guanidínu bola jeho detailná kryštalografická analýza prvýkrát opísaná až 148 rokov po jeho prvej syntéze.[2] V roku 2013 bola presne určená pozícia vodíkových atómov pomocou jednokryštálovej neutrónovej difrakcie.[3]
Výroba
[upraviť | upraviť zdroj]Guanidín sa dá získať z prírodných zdrojov a prvýkrát ho izoloval Adolph Strecker rozkladom guanínu.[4] Prvýkrát bol syntetizovaný v roku 1861 oxidatívnou degradáciou aromatického prírodného produktu, guanínu, izolovaného z peruánskeho guána.[5]
Laboratórnou metódou prípravy guanidínu je mierny (180 – 190 °C) tepelný rozklad suchého tiokyanátu amónneho v bezvodom prostredí:
Komerčný proces výroby sa skladá z dvoch krokov. Prvým je reakcia dikyanamidu s amónnymi soľami. Pri tejto amonolýze vzniká biguanidín, z ktorého vznikajú soli s guanidíniovým katiónom. V druhom kroku reagujú soli so zásadou, napríklad metoxidom sodným.[4]
Chemické vlastnosti
[upraviť | upraviť zdroj]Guanidíniový katión
[upraviť | upraviť zdroj]S pKb = 0,4 je guanidín silná zásada. Väčšina guanidínových derivátov sú v skutočnosti soli obsahujúce jeho konjugovanú kyselinu.
Konjugovaná kyselina sa nazýva guanidínium a jeho vzorec je C(NH2)3+. Je to planárny symetrický ión, ktorý pozostáva z troch amino skupín viazaných na centrálny uhlíkový atóm s kovalentnou väzbou s rádom väzby 4/3. Vo vodných roztokoch je to veľmi stabilný jednomocný katión vďaka jeho výhodnej rezonančnej stabilite náboja a efektívnej solvatácii molekulami vody. Výsledkom toho je pKaH = 13.6,[6] čo znamená, že guanidín je vo vode veľmi silná zásada. V neutrálnej vode existuje prakticky výhradne ako guanidínium.
-
3D model
-
Rezonančný hybrid
-
Rezonančné štruktúry
Skúšky na guanidín
[upraviť | upraviť zdroj]Guanidín sa dá selektívne detegovať pomocou 1,2-naftochinón-4-sulfonátu sodného (Folinovo činidlo) a okyslenej močoviny.[7]
Použitie
[upraviť | upraviť zdroj]Priemysel
[upraviť | upraviť zdroj]Najväčší komerčný záujem je o dusičnan guanidínu, [C(NH2)3]NO3, ktorý sa používa ako propelant napríklad v airbagoch.
Biochémia
[upraviť | upraviť zdroj]Guanidín sa pri fyziologickom pH nachádza v protónovanej podobe ako guanidínium.
Guanidíniumchlorid je chaotropné činidlo a používa sa na denaturáciu proteínov. Guanidíniumchlorid denaturuje proteíny. Existuje lineárny vzťah medzi koncentráciou guanidíniumchloridu a voľnou energiou rozbalenia proteínu.[8] Vo vodných roztokoch, kde je koncentrácia guanidíniumchloridu 6 M, strácajú skoro všetky proteíny svoju sekundárnu štruktúru a stávajú sa z nich náhodne usporiadané peptidové reťazce. Guanidíniumtiokyanát sa takisto používa na denaturáciu rôznych biologických vzoriek.
Guanidíniumchlorid sa používa ako adjuvans pri liečbe botulizmu.[9] Prvýkrát bol použitý v roku 1968,[10] ale aktuálne sa jeho úloha pri liečbe pokladá za kontroverznú[11] – u niektorých pacientov totiž po podaní lieku nenastalo zlepšenie.
Iné
[upraviť | upraviť zdroj]Guanidíniumhydroxid je aktívnou látkou niektorých vlasových relaxérov (prípravkov na vyrovnanie vlasov) bez lúhu.
Deriváty guanidínu
[upraviť | upraviť zdroj]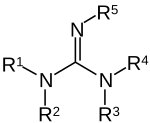
Guanidíny sú skupina organických zlúčenín, ktoré obsahujú spoločnú funkčnú skupinu, ktorej všeobecná štrukúra je (R1R2N)(R3R4N)C=NR5. Centrálna väzba na túto skupinu je imínová a táto skupina je štruktúrne podobná amidínom a močovinám. Príkladom guanidínov sú arginín, kreatín, triazabicyklodecén a saxitoxín. Galegín je izoamylén guanidínu.[12]
Referencie
[upraviť | upraviť zdroj]- ↑ First structural characterization of guanidine. Chem. Commun., 2007, s. 3180–2. DOI: 10.1039/B705100J. PMID 17653381.
- ↑ Solid-state structure of free base guanidine achieved at last. Chem. Eur. J., 2009, s. 5651–5. DOI: 10.1002/chem.200900508. PMID 19388036.
- ↑ Single-Crystal Neutron Diffraction Study on Guanidine, CN3H5. Cryst. Growth Des., 2013, s. 1730–5. DOI: 10.1021/cg400054k.
- ↑ a b GÜTHNER, Thomas; MERTSCHENK, Bernd; SCHULZ, Bernd. Guanidine and Derivatives. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2006-07-15. DOI: 10.1002/14356007.a12_545.pub2. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a12_545.pub2 S. a12_545.pub2. (po anglicky)
- ↑ STRECKER, A.. Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin. Liebigs Ann. Chem., 1861, s. 151–177. Dostupné online. DOI: 10.1002/jlac.18611180203.
- ↑ PERRIN, D. D.. Dissociation Constants of Organic Bases in Aqueous Solution. Supplement. vyd. London : Butterworths, 1972. .
- ↑ SULLIVAN, M. X.. A Colorimetric Test for Guanidine. Proceedings of the Society for Experimental Biology and Medicine, 1935-10-01, s. 106–108. ISSN 0037-9727. DOI: 10.3181/00379727-33-8270C. (po anglicky)
- ↑ SMITH, J. S.; SCHOLTZ, J. M.. Guanidine hydrochloride unfolding of peptide helices: separation of denaturant and salt effects. Biochemistry, 1996-06-04, roč. 35, čís. 22, s. 7292–7297. PMID: 8679559. Dostupné online [cit. 2022-01-14]. ISSN 0006-2960. DOI: 10.1021/bi960341i.
- ↑ Botulism, type A, and treatment with guanidine. Annals of Neurology, 1979, s. 69–71. DOI: 10.1002/ana.410060117. PMID 389150.
- ↑ Botulism and Guanidine: Ten Years Later. J. Am. Med. Assoc., 1978, s. 2276–7. DOI: 10.1001/jama.1978.03290210058027. PMID 702753.
- ↑ BROOK, Itzhak. Pediatric Anaerobic Infections: Diagnosis and Management. 3rd. vyd. [s.l.] : Taylor & Francis, 2001. ISBN 0824741862. S. 529.
- ↑ The blooming of the French lilac. Journal of Clinical Investigation, 2001, s. 1105–7. DOI: 10.1172/JCI14178. PMID 11602616.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Guanidine na anglickej Wikipédii.