Prvá termodynamická veta
Prvá termodynamická veta alebo prvý termodynamický zákon je vo fyzike nasledujúci zákon:
Znenie:
- formulácia 1: Každá fyzikálna sústava má stavovú veličinu nazývanú vnútorná energia (U), ktorá sa mení len prostredníctvom výmeny energie s okolím (objemová práca, tepelná výmena)
- formulácia 2: ΔU = ΔQ + Δ(Wp + Wk) , kde:
- ΔU: zmena vnútornej energie sústavy
- ΔQ: zmena tepla sústavy (+ znamená dodanie, - znamená odobratie)
- Δ(Wp + Wk): vykonaná/spotrebovaná objemová práca (+ znamená, že ju sústava vykonala, - znamená, že ju sústava spotrebovala)
- formulácia 3: Nie je možné skonštruovať perpetuum mobile prvého druhu (teda stroj, ktorý cyklicky opakuje dej len s počiatočnou energiou)
Aplikácia
[upraviť | upraviť zdroj]Prvý zákon termodynamiky môžeme aplikovať na deje prebiehajúce v uzavretých sústavách. Konvencia: Objemovú prácu budeme označovať súhrnne, nie ako rozdiel spotrebovanej a vykonanej. O tom, o akú prácu ide rozhoduje jej znamienko:
- — práca bola sústavou spotrebovaná (resp. jej bola dodaná)
- — prácu vykonala sústava
Aplikácia na dej izochorický
[upraviť | upraviť zdroj]Pri izochorickom deji platí , a preto je objemová práca vykonaná sústavou nulová. Prvý termodynamický zákon nadobúda tvar:
Zmena vnútornej energie sústavy pri izochorickom deji je teda rovná vymenemému teplu. Toto teplo môžeme vztiahnuť na teplotnú zmenu sústavy resp. na jej hmotnosť. Získame tak izochorickú mernú tepelnú kapacitu :
Aplikácia na dej izobarický
[upraviť | upraviť zdroj]Pri izobarickom deji platí Aby bola táto podmienka splnená aj pri výmene tepla, musí sústava konať objemovú prácu. Preto platí prvý termodynamický zákon v nezmenenej podobe

Pre objemovú prácu vykonanú pri izobarickom deji platí:
Ak si z prvého zákona termodynamiky pre dej izobarický odvodíme :
získame vzorec pre výpočet izobaricky vymeneného tepla, ktoré nazývame zmena entalpie :
Aj zmenu entalpie pri izobarickom deji môžeme vztiahnuť na zmenu teploty sústavy resp. jej hmotnosť, získame tak izobarickú mernú tepelnú kapacitu :
Aplikácia na dej izotermický
[upraviť | upraviť zdroj]Pri izotermickom deji platí a preto nemôže dochádzať ku zmene vnútornej energie:
Aj napriek tomu, že pri izotermickom deji nedochádza ku zmene vnútornej energie, dochádza ku výmene energie vo forme tepla aj práce. Aby bolo splnené , musí platiť:
Objemovú prácu vykonanú pri izotermickom deji vypočítame zo vzorca:
Zo vzorca vidíme, že rovnaký vzorec môžeme použiť aj na výpočet vymeneného tepla, len obrátime znamienko:
(Výber znamienok je konvenciou.)
Aplikácia na dej adiabatický
[upraviť | upraviť zdroj]Pri adiabatickom deji je sústava dokonale tepelne izolovaná od okolia, platí teda . Pre adiabatický dej platí prvý zákon termodynamický v tvare:
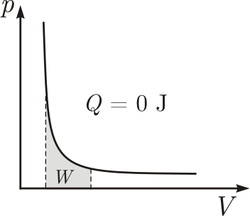
Takto vykonanú resp. dodanú prácu vnímame ako zmenu teploty sústavy, a preto pre prácu platí:
( — počet molov plynu) Deje v adiabatických sústavách najlepšie popisuje Poissonov zákon. Za povšimnutie stojí, že krivka adiabaty sa veľmi podobá krivke izotermy, ale je výrazne prudšia.



























